Control in vitro de antracnosis (colletotrichum gloeosporioides) aislado de annona muricata l. con extractos vegetales
In vitro control of anthracnosis (colletotrichum gloeosporioides) isolated from annona muricata l. with vegetable extracts
 https://orcid.org/0000-0002-0471-5025
https://orcid.org/0000-0002-0471-5025
Sandra Isabel Ramírez González Universidad Autónoma de Chiapas, Tuxtla Gutiérrez, Chiapas, México. sanirg@yahoo.com
 https://orcid.org/0000-0002-1563-1521
https://orcid.org/0000-0002-1563-1521
Orlando López Báez Universidad Autónoma de Chiapas, Tuxtla Gutiérrez, Chiapas, México. olopez@unach.mx
 https://orcid.org/0000-0003-4200-4547
https://orcid.org/0000-0003-4200-4547
Judith Prieto Méndez Universidad Autónoma del Estado de Hidalgo, Hidalgo, México. jprieto@uaeh.edu.mx
 https://orcid.org/0000-0001-5705-1704
https://orcid.org/0000-0001-5705-1704
DOI: https://doi.org/10.31644/IMASD.31.2022.a02
Fecha de recepción: 11 de enero 2022
Fecha de aceptación: 27 de abril 2022
Fecha de publicación: 01 de octubre 2022
Resumen
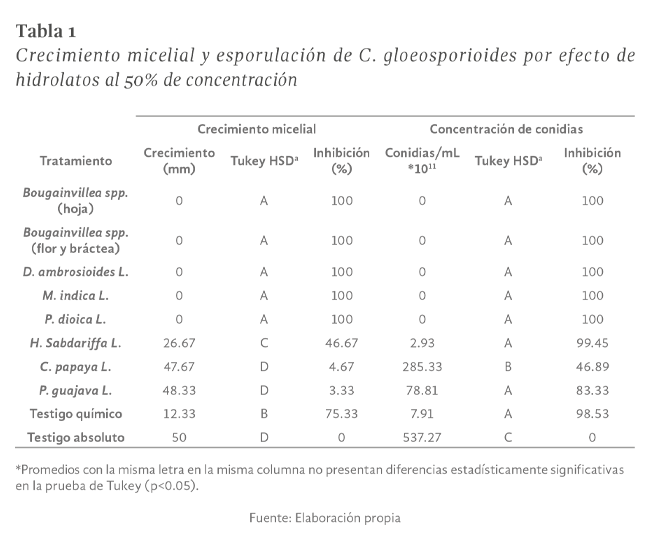
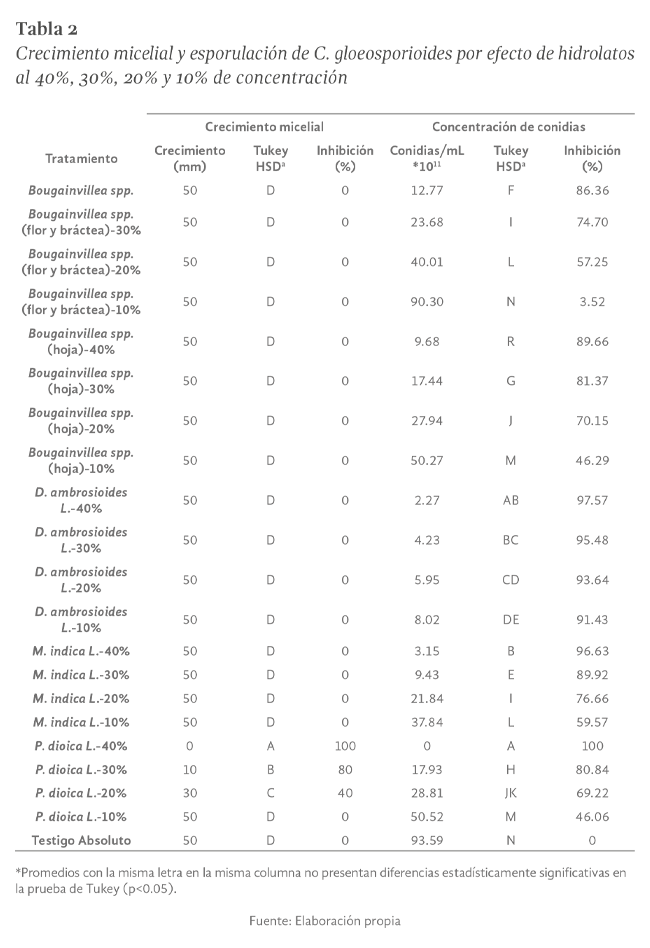
La colletotrichum gloeosporioides, es una enfermedad de gran importancia en el cultivo de guanábana ya que puede llegar a provocar grandes pérdidas productivas al estar presente en todas las etapas fenológicas del cultivo; como una alternativa al uso de productos de síntesis química para su control, se investigó el efecto in vitro de ocho extractos en forma de hidrolato obtenidos a partir de Bougainvillea spp., Hibiscus sabdariffa L., Mangifera indica L. , Carica papaya L., Pimenta dioica L. y Psidium guajava L., utilizando la técnica de medios envenenados. En la primera etapa se evaluaron los hidrolatos al 50% de concentración V/V, aquellos que lograron la total inhibición del patógeno se les determinó su concentración mínima inhibitoria (CMI), se cuantificó el crecimiento diario del diámetro radial del patógeno, así como el número de conidias totales y germinadas. Los resultados muestran que todas las plantas evaluadas poseen compuestos con capacidad fungistática sobre C. gloeosporioides al probarlas in vitro; en la primera etapa P. dioica L., D. ambrosioides L., M. indica L. y Bougainvillea spp. inhibieron el desarrollo total del patógeno, mientras que H. sabdariffa L. y P. guajava L. mostraron una inhibición menor en el crecimiento micelial; sin embargo evidenciaron alta capacidad antiesporulante (99.45% y 83.33% respectivamente); por otra parte, C. papaya mostró baja inhibición tanto en esporulación como en el crecimiento del micelio. En la segunda etapa únicamente P. dioica L. inhibió el desarrollo de C. gloeosporioides, con la CMI más baja (40%), los demás tratamientos no inhibieron el crecimiento micelial, pero todos mostraron capacidad antiesporulante según la prueba Tukey. El hidrolato de P. dioica L. mostró la menor CMI con 40% (V/V), mientras que para los hidrolatos de D. ambrosioides L., Bougainvillea spp. (hoja, flor y bráctea) y M. indica L. la CMI fue de 50% (V/V) sobre C. gloeosporioides.
Palabras clave: Colletotrichum gloeosporioides; Hidrolatos; Metabolitos secundarios; Antracnosis; Guanábana; Inhibición
-Abstract-
colletotrichum gloeosporioides, is a disease of great importance in soursop cultivation since it can cause large production losses by being present in all phenological stages of the crop, as an alternative to the use of chemical synthesis products for its control, it was investigated the in vitro effect of eight extracts in hydrolate form obtained from Bougainvillea spp., Hibiscus sabdariffa L., Mangifera indica L., Carica papaya L., Pimenta dioica L. and Psidium guajava L., using the poisoned media technique . In the first stage, the hydrolates were evaluated at 50% concentration V/V, those that achieved total inhibition of the pathogen were evaluated again to calculate their minimum inhibitory concentration (MIC), the daily growth of the radial diameter of the pathogen as well as the number of total and germinated conidia. The results show that all the evaluated plants have compounds with fungistatic capacity on C. gloeosporioides when tested in vitro; in the first stage P. dioica L., D. ambrosioides L., M. indica L. and Bougainvillea spp. inhibited the total development of the pathogen, while H. sabdariffa L. and P. guajava L. showed a minor inhibition in mycelial growth; however, they showed high antisporulant capacity (99.45% and 83.33% respectively); on the other hand, C. papaya showed low inhibition in both sporulation and mycelial growth. In the second stage, only P. dioica L. inhibited the total development of C. gloeosporioides, for which it achieved the lowest MIC with 40%, the other treatments failed to inhibit mycelial growth but all showed antisporulant capacity according to the comparison test Stocking by Tukey. The P. dioica L. hydrolate showed the lowest minimum inhibitory concentration with 40% (V/V), while for the hydrolates the D. ambrosioides L., Bougainvillea spp. (leaf, flower and bract) and M. indica L. the minimum inhibitory concentration was 50% (V/V) on C. gloeosporioides.
Keywords: colletotrichum gloeosporioides; hydrolates; secondary metabolites; anthracnose; soursop; inhibition