Distribución Potencial Actual del Dorado (Coryphaena hippurus) en el Ecosistema Pelágico de la Costa Sureste del Océano Pacífico Mexicano
Current potential distribution of the Dorado (Coryphaena hippurus) in the pelagic ecosystem of the southeast coast of the Mexican Pacific Ocean
 https://orcid.org/0009-0008-8753-8976
https://orcid.org/0009-0008-8753-8976
Tamara Rioja Paradela tamara.rioja@unicach.mx Posgrado en Desarrollo Sustentable y Gestión de Riesgos, Facultad de Ingeniería Universidad de Ciencias y Artes de Chiapas
 https://orcid.org/0000-0003-2127-0790
https://orcid.org/0000-0003-2127-0790
Arturo Carrillo Reyes arturo.carrillo@unicach.mx OIKOS: Conservación y Desarrollo Sustentable, A.C. San Cristóbal de Las Casas, Chiapas, México
 https://orcid.org/0000-0001-8351-5496
https://orcid.org/0000-0001-8351-5496
Francisco López Rasgado franciscoj.lopez@unicach.mx Universidad de Ciencias y Artes de Chiapas Instituto de Ciencias Biológicas, Sede Tonalá, Chiapas México
 https://orcid.org/0000-0002-2982-3110
https://orcid.org/0000-0002-2982-3110
Leonel Santizo López leonel.santizol@e.unicach.mx Doctorado en Ciencias en Biodiversidad y Conservación de Ecosistemas Tropicales Instituto de Ciencias Biológicas, Universidad de Ciencias y Artes de Chiapas
 https://orcid.org/0000-0002-1290-5072
https://orcid.org/0000-0002-1290-5072
DOI: https://doi.org/10.31644/IMASD.38.2024.a04
Fecha de recepción: 11 de agosto de 2023
Fecha de aceptación: 01 de marzo de 2024
Fecha de publicación: 01 de octubre de 2024
Resumen
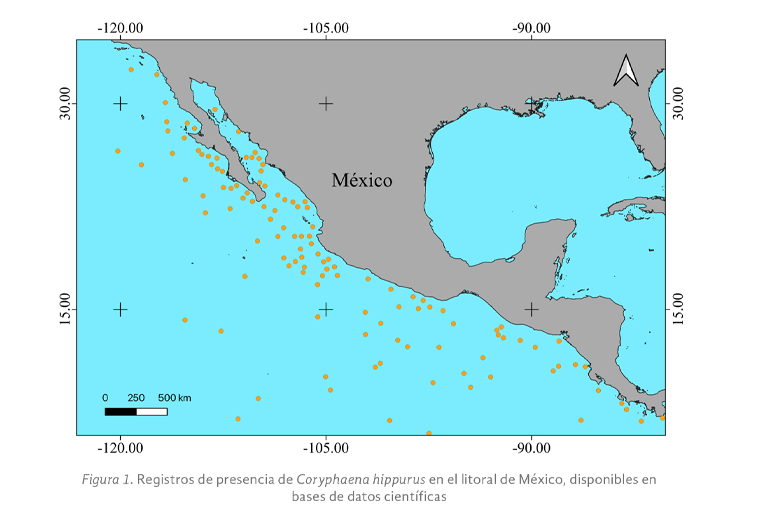
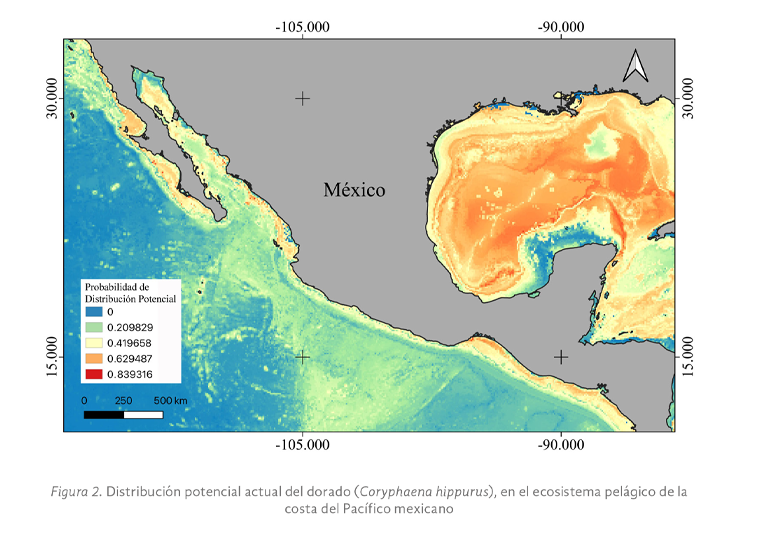
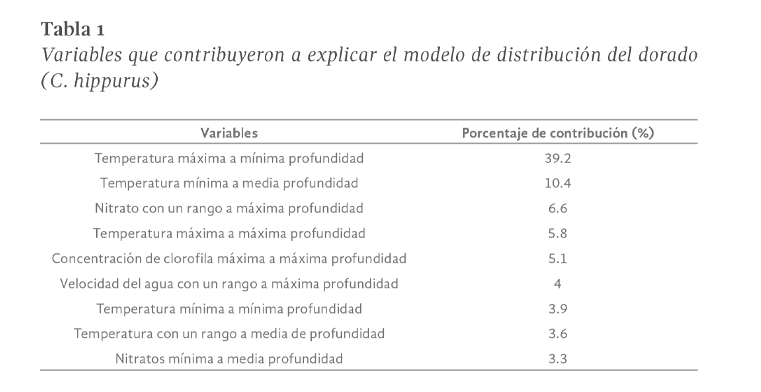
Las actividades antropogénicas han derivado en un acelerado calentamiento global, que está elevando la temperatura media de la atmósfera terrestre y de los océanos. El mal manejo de las actividades productivas en los océanos ha resultado en problemas ambientales como la sobrepesca y la contaminación, afectando negativamente la distribución y las dinámicas poblacionales de muchas especies de fauna marina. Una de las especies importantes en el ecosistema pelágico es el dorado (Coryphaena hippurus), uno de los principales depredadores marinos cuya función ecológica es controlar las poblaciones de peces herbívoros, manteniendo así el equilibrio de la trama alimenticia. Por ello, la extinción de esta especie podría producir un desequilibrio de tipo “top-down” en el ecosistema pelágico. Esta investigación tiene el objetivo, por primera vez, modelar la distribución potencial actual del dorado (C. hippurus) a lo largo de toda la costa del Pacífico mexicano mediante el algoritmo de Máxima Entropía (MaxEnt), a partir del contraste de factores ecológicos y climáticos con los registros de la especie reportados en bases de datos científicas como SNIB-CONABIO (Sistema Nacional de Información en Biodiversidad-Comisión nacional para el Uso y Conocimiento de la Biodiversidad) y Gbif. Los resultados sugieren que el dorado (C. hippurus) se distribuye a lo largo de toda la costa del Pacífico mexicano, ampliando así el área de distribución anteriormente reportada en la literatura científica para el norte de la costa de los Estados Unidos de América. Las tres variables que más contribuyeron a explicar el modelo de distribución potencial fueron la Temperatura Máxima a Mínima Profundidad, la Temperatura Mínima a Media Profundidad, y el Nitrato con un Rango a Máxima Profundidad. Estos resultados proporcionan información clave para determinar las áreas prioritarias de conservación (manejo sustentable) del dorado (C. hippurus) en la costa mexicana, así como las variables ambientales que influyen en su distribución.
Palabras clave: Distribución; Manejo sustentable; Modelado; Peces; Sistema de información geográfica
-Abstract-
Anthropogenic activities have led to accelerated global warming that is raising the average temperature of the Earth's atmosphere and oceans; the poor management of productive activities in the oceans results in environmental problems, such as overfishing and pollution, negatively affecting the distribution and population dynamics of many marine fauna species. One of the important species in the pelagic ecosystem is the Mahi-Mahi (Coryphaena hippurus), one of the main marine predators whose ecological function is to control the populations of herbivorous fish and thereby maintain the balance of the food web; therefore, the extinction of this fish can produce a "top-down" imbalance in the pelagic ecosystem. The present research aims, for the first time, to model the current potential distribution of Mahi-Mahi (C. hippurus) along the entire Mexican Pacific coast (using the Maximum Entropy algorithm or MaxEnt), based on the contrast of ecological and climatic factors with the species' records reported in scientific databases such as SNIB-CONABIO (National System of Information on Biodiversity-National Commission for the Use and Knowledge of Biodiversity) and Gbif. The results suggest that Mahi-Mahi (C. hippurus) is distributed along the entire Mexican Pacific coast, expanding the distribution area previously reported in the scientific literature to the north coast of the United States of America. The three variables that most contributed to explaining the potential distribution model were Maximum Temperature at Minimum Depth, Minimum Temperature at Medium Depth, and Nitrate with a Range at Maximum Depth. These results provide key information to determine the priority conservation areas (sustainable management) of Mahi-Mahi (C. hippurus) on the Mexican coast and the environmental variables that influence its distribution.
Keywords: Distribution; Sustainable management; Modeling; Fishes; Geographic information systems