Efecto antifúngico de esporas encapsuladas de Metarhizium anisopliae sobre el desarrollo de plantas de frijol (Phaseolus vulgaris L) infectadas con Fusarium moniliforme
Antifungal Effect Of Encapsulated Metarhizium anisopliae spores on the development of bean plants (Phaseolus vulgaris L) infected with Fusarium moniliforme
 https://orcid.org/0000-0002-4743-9112
https://orcid.org/0000-0002-4743-9112
Porraz-Ruiz, María Laura maría.pr@tuxtla.tecnm.mx
 https://orcid.org/0000-0003-4884-7545
https://orcid.org/0000-0003-4884-7545
Hernández-Garduza, Salvador salvador.hr@tuxtla.tecnm.mx
 https://orcid.org/0009-0009-9426-9628
https://orcid.org/0009-0009-9426-9628
Gómez-Salinas, Jorge Armando jorge.gs@tuxtla.tecnm.mx
 https://orcid.org/0000-0003-3611-5822
https://orcid.org/0000-0003-3611-5822
Tecnológico Nacional de México, Campus Tuxtla. Tuxtla Gutiérrez, Chiapas, México.
DOI: https://doi.org/10.31644/IMASD.34.2023.a01
Fecha de recepción: 01 abril de 2023
Fecha de aceptación: 07 de julio de 2023
Fecha de publicación: 01 de Octubre de 2023
Resumen
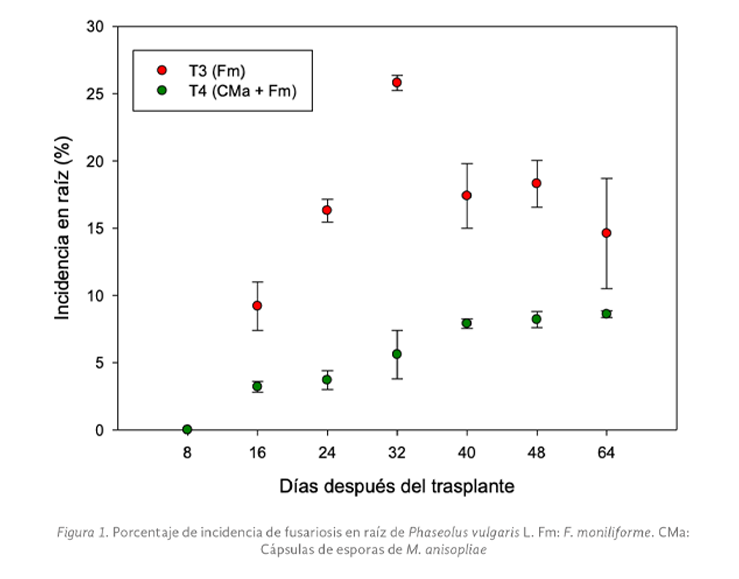
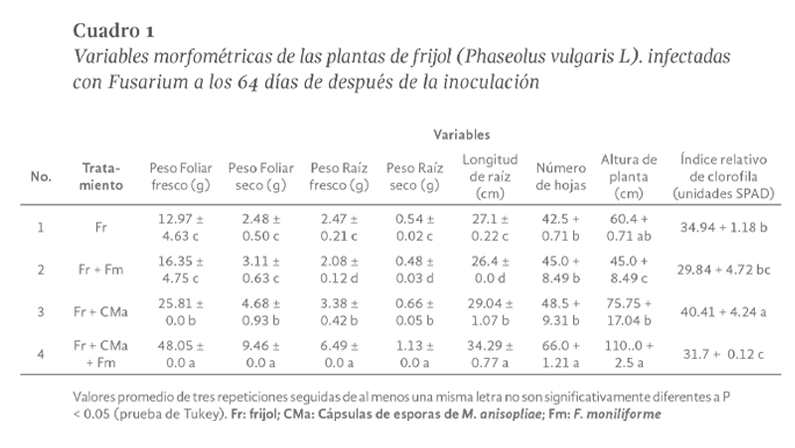
La producción anual del cultivo de frijol (Phaseolus vulgaris L.) en México se reduce principalmente por enfermedades y plagas. Una alternativa de control biológico es el empleo de esporas de Metarhizium anisopliae por su capacidad de colonizar la rizosfera, pero su efectividad disminuye por la sensibilidad a factores ambientales. Por tanto, el objetivo de este estudio fue analizar el potencial de biocontrol de una formulación de alginato con esporas de M. anisopliae en el cultivo de frijol infectado con Fusarium. Se planteó un diseño experimental completamente al azar, utilizando plantas sanas como control, también se inocularon de plantas con una suspensión de Fusarium oxysporum en el sustrato y adicionalmente a una parte de estas se les depositó en la base del tallo 1 g de cápsulas de alginato que contenían esporas de M. anisopliae por planta, se midieron los parámetros morfométricos cada 8 días durante 8 semanas, así como la aparición de síntomas de fusariosis. Tras analizar los datos obtenidos se observó que hubo diferencias significativas a los 64 días después de la inoculación (ddi) siendo mayor el peso seco foliar y de raíces, así como la longitud de raíz en las plantas donde hubo interacción de Fusarium y las esporas encapsuladas de Metarhizium, esto sugiere que la presencia de ambos microorganismos afectó de forma positiva el metabolismo de las plantas, superando los beneficios de Metarhizium como promotor de crecimiento. Además, se observó que el porcentaje de incidencia en la raíz disminuyó con el tratamiento 4 sin presentar diferencia significativa de 32 a 64 ddi con valores similares al tratamiento 3 a los 16 días. Se concluyó que la aplicación de esporas encapsuladas de M. anisopliae es una opción viable para reducir el efecto del marchitamiento por Fusarium en el cultivo de frijol.
Palabras clave: Encapsulado; Metarhizium anisopliae; Alginato; Incidencia de la enfermedad
-Abstract-
The annual production of the bean crop (Phaseolus vulgaris L.) in Mexico is reduced mainly by diseases and pests. An alternative for biological control is the use of Metarhizium anisopliae spores due to their ability to colonize the rhizosphere, but their effectiveness decreases due to sensitivity to environmental factors. Therefore, the objective of this study was to analyze the biocontrol potential of an alginate formulation with spores of M. anisopliae in the bean crop with Fusarium infected. A completely randomized experimental design was proposed using healthy plants as control, plants were also inoculated with a suspension of Fusarium oxysporum in the substrate and additionally to a part of these plants, 1 g of capsules of alginate with M. anisopliae spores per plant was deposited at the stem base, the morphometric parameters were measured every 8 days for 8 weeks, as well as the appearance of Fusarium wilt symptoms. After analyzing the data obtained, it was shown that there were significant differences 64 days after inoculation (ddi), with greater leaf and root dry weight, as well as root length in plants where there were interactions between Fusarium and encapsulated spores. of Metarhizium, which suggests that the presence of the microorganisms positively affected the treatment of the plants, surpassing the benefits of the application of Metarhizium reported as a growth promoter. In addition, the incidence of the root disease will occur during the first 32 days of cultivation. It was concluded that the application of encapsulated spores of M. anisopliae is a viable option as a biocontrol to reduce the effect of Fusarium wilt in the bean crop.
Keywords: encapsulated; Metarhizium anisopliae; alginate; disease incidence