Introducción
En los últimos años, la publicación de numerosos estudios realizados a cuerpos de agua, alertan sobre la presencia de una variada cantidad de productos químicos como fenoles, sulfuros, cromo, entre otros, además de compuestos orgánicos refractarios presentes en efluentes industriales, como los colorantes provenientes de las aguas residuales de la industria textil. Estos últimos y en especial los colorantes azoicos, tienen un efecto directo y negativo sobre los sistemas acuáticos, aún en concentraciones bajas (Bermeo y Tinoco 2016; Hanane et al., 2020). Los colorantes azoicos están compuestos de dos moléculas de nitrógeno unidas por un enlace doble, de alta estabilidad química y baja biodegradabilidad, por lo que ante este tipo de moléculas, autores como Barrera-Andrade et al. (2023) y Brdaric et al. (2024), mencionan que los métodos convencionales de tratamiento como la adsorción, la floculación, los lodos activados, entre otros, no son eficientes para decolorar los efluentes en aguas residuales. Una opción para el tratamiento de este tipo de compuestos, son los denominados procesos de oxidación avanzada (POA) (Nidheesh et al., 2018).
Dentro de los diferentes tratamientos que componen los POA se encuentra la oxidación anódica (OA), misma que consta en la generación de cantidades suficientes de radicales hidroxilos (•OH) provenientes de la oxidación del agua (Velázquez 2015; Xie et al., 2022). Fundamentalmente autores como Moreira et al. (2017) y Sánchez et al. (2020) señalan las características de estos radicales; en primer lugar, estos representan la segunda especie más reactiva en la naturaleza, es decir, tienen un potencial redox de 2.8 V; en segundo lugar, reaccionan de forma no selectiva con la mayoría de los compuestos orgánicos, por lo que, la mineralización de los contaminantes puede ser alcanzada, lo cual también dependerá del tipo de electrodo empleado y de los contaminantes tratados. Uno de los electrodos más efectivos para lograr la combustión de los contaminantes son los denominados ánodos de diamante dopado de boro (DDB), los cuales tienen un valor alto de sobre potencial para la evolución del oxígeno, favoreciendo con ello los mecanismos de oxidación completa hasta CO2 (Klidi et al., 2018).
Los POA pueden ofrecer una mineralización completa de los contaminantes en el agua problema, como es el caso de la OA. Se trata de un proceso completamente ecológico donde no hay transferencia de contaminantes ni producción de lodos (Sánchez et al., 2020). La OA es un proceso donde interactúan las especies orgánicas y electrodos, al presentarse una transferencia de electrones, esta puede ocurrir en el ánodo por generación de oxígeno activo fisisorbido (•OH), o quimisorbido para obtener oxígeno en óxidos metálicos (Barrera-Díaz et al., 2014; Bermeo y Tinoco, 2016).
El proceso de OA se ha probado en aguas problema contaminadas con colorantes, tal es el caso del estudio reportado por Yingying et al. (2021), quienes ensayaron la remoción de colorantes azoicos como el cristal violeta, con electrodos de Ti/BDD con densidades de corriente entre 2.5 y 15 mA cm-2, bajo agitación constante y pH neutro, y con remociones del 95% de TOC. Otro estudio es el realizado por La Rosa y Ponce (2007), donde se evaluó la remoción de color del naranja de metilo, utilizando electrodos Ti/Co3O4, Ti/PbO2 y grafito, con una densidad de corriente de 2.5 mA cm-2. y diferentes valores de pH (2, 5 y 8). Como electrolito soporte se empleó NaCl al 2%. En general, estos ensayos mostraron una remoción de color por encima del 80%. También se reportan los resultados obtenidos con otros tipos de colorantes, tal es el caso del estudio conducido por Petrucci et al. (2015), quienes mediante oxidación anódica aplicado a el colorante verde 19, lograron en 15 minutos de reacción remociones del 100% en color y 53% de TOC usando electrodos de DDB, bajo las siguientes condiciones: intensidad de corriente de 300 mA, pH 7 y con 100 mg/L Na2SO4 como soporte electrolítico. Para el caso de la aplicación de PAO en aguas residuales provenientes de las pruebas de tinción de Gram, hasta donde la revisión de la literatura fue posible, únicamente se reporta el trabajo de Granda-Ramírez et al. (2018), quienes aplicaron la fotocatálisis heterogénea con TiO2, trabajando muestras diluídas al 10%. El tiempo de reacción fue de 2 h y la DQO se redujo en 40%, y el color en un 75%.
Es así que en el presente estudio, a diferencia de la mayor parte de los trabajos reportados, donde los PAO se han aplicado a un colorante en específico, en el presente documento se tuvo como objetivo evaluar la eficiencia de la remoción de DQO y color a través del método de OA, para una mezcla de residuos líquidos provenientes de las pruebas de Tinción de Gram que se realizan en el laboratorio de docencia de Ingeniería Ambiental de la Universidad de Ciencias y Artes de Chiapas (UNICACH). Esta mezcla se caracteriza por estar constituida principalmente por colorantes como: azul de metileno, cristal violeta, yodo, safranina y azul lactofenol, naranja de metilo, además de otros compuestos como acetona y alcohol.
Metodología
Caracterización del agua problema
Para este estudio, el agua problema generada semestralmente en el laboratorio como subproducto de las prácticas de microbiología de tinción de Gram, fue caracterizada con los siguientes parámetros: DQO, color, sólidos suspendidos totales (SST) y pH. La prueba de la DQO, se cuantificó empleando el micro método de reflujo cerrado, digestando la muestra a 150°C durante 2 horas, y posteriormente leyendo a 620 nm en un espectrofotómetro HACH DR-5000. En lo que respecta al color, para su determinación se usó un colorímetro HACH DR/890, y para los SST, se empleó el método gravimétrico. Finalmente, el pH solo se ajustó hacia el inicio del proceso y se volvió a determinar al final del proceso, empleando el equipo HI 3220 HANNA. Todos los parámetros analizados fueron llevados a cabo siguiendo los métodos estandarizados (APHA, 2012).
Diseño experimental
Los ensayos de electrodegradación fueron llevados a cabo en una celda electrolítica no dividida (vaso de precipitado de 150 mL) operada bajo un régimen discontinuo. El sistema se compuso de una placa en la parte superior para la sujeción de los electrodos, en donde el ánodo (electrodo de trabajo) y cátodo (electrodo de desgaste) fueron de diamante dopado con boro y grafito, respectivamente. Las dimensiones de ambos fueron equivalentes, esto es, 2.5 cm de ancho, 5 cm de altura y 1.15 mm de espesor. Los electrodos se colocaron de forma paralela a 2 cm de separación y con un área sumergida de 6 cm2. En la parte superior de la placa de soporte se dejó un orificio que permitió extraer el volumen de muestra necesaria para la medición de color y DQO.
La corriente fue aportada por una fuente de poder marca EXTECH modelo 382270, en la cual se utilizaron cables y caimanes para conducir la corriente hacia los electrodos. El medio electrolítico se mantuvo en una placa CORNING PC420D con agitación constante durante 2 horas (Figura 1). Para los ajustes de pH, una solución de H2SO4 al 10% fue usada.
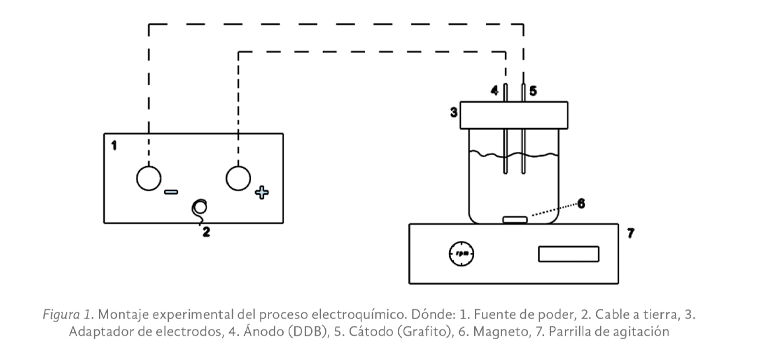
Diseño experimental y análisis de datos
Un diseño experimental de 3x3 fue llevado a cabo, teniendo como variables de estudio a la intensidad de corriente (i) y el pH, cada una de ellas con tres niveles (Tabla 1). Los niveles fueron establecidos de acuerdo con lo reportado en otros estudios (Yingying et al., 2021 y Barrera-Díaz et al., 2014). Para el caso de la velocidad de agitación, fue manejada como un factor fijo a 300 rpm, velocidad seleccionada considerando lo reportado por Sánchez et al. (2020) y Chiliquinga et al. (2020).

El volumen de muestra utilizado fue de 100 mL para cada ensayo, bajo una dilución 1:50, dilución seleccionada posterior a realizar pruebas preliminares, además de que con la finalidad de hacer más factible la aplicación del proceso, se trabajó a temperatura ambiente. Finalmente, para favorecer el flujo de la corriente eléctrica en el medio electrolítico, se agregó sulfato de sodio 0.05 M. Este agente electrolítico bajo esta concentración, de acuerdo con Rubí et al. (2023), favorece las remociones de color y materia orgánica (DQO y COT) en el medio de reacción, tal y como también se constata con lo reportado por Yungying et al. (2021), quienes evaluaron el efecto de diferentes tipos de electrolitos en la remoción de contaminantes, y el sulfato de sodio fue el mejor de ellos. Es importante mencionar que pruebas preliminares realizadas con y sin la inducción de corriente eléctrica y de electrolito soporte, permitieron ver la influencia de ambos factores para que el proceso electroquímico se lleve a cabo.
Respecto a las variables de respuesta (color y DQO), se utilizó la ecuación 1 para determinar las eficiencias de remoción alcanzadas, partiendo de los resultados de concentración inicial (Ci) y concentración final (Cf). Los resultados obtenidos, fueron analizados usando el programa estadístico SigmaPlot 12.0, mediante un análisis de varianza donde el intervalo de confianza fue de 95 % y cada tratamiento se realizó por triplicado. En cada caso, el análisis se realizó tras comprobar los supuestos de normalidad (Shapiro-Wilk), independencia y homocedasticidad. Cuando el análisis mostró la existencia de una diferencia significativa entre tratamientos, se realizó el procedimiento de comparación múltiple (Prueba de Tukey).
% Remoción = [(Ci – Cf) / Ci] x 100 Ecu. 1
Donde:
Ci = Concentración inicial
Cf = Concentración final
Resultados y análisis
Caracterización del agua problema
Los resultados de la caracterización físico-química al agua problema usada en los ensayos bajo la dilución 1:50, se presentan en la Tabla 2, además de su comparación con valores reportados por otros autores.

De la Tabla 2 puede observarse que el valor de pH obtenido (9.3), es similar al encontrado
por Nidheesh et al. (2018) y cercano a lo reportado por Yusuf y Reza (2012), quienes también realizaron ensayos sobre la eliminación de colorantes por un proceso de oxidación. En todos los casos los valores de pH están en el rango básico.
En su apariencia, la tonalidad del residuo de laboratorio era morado y ligeramente viscoso (algo característico de sustancias básicas), y con una lectura en DQO de 613 mg/L y 234 Pt-Co en color. Para el caso de la DQO, el valor mostrado en la Tabla 2, fue más bajo que el reportado por Nidheesh et al. (2018), caso contrario en el color, donde el valor reportado es mayor que lo mencionado por Yusuf y Reza (2012) aunque realmente el valor del agua problema llega a ser mucho mayor si se parte de su valor concentrado.
En general, se observa que los residuos de tinción Gram representan un agua problema compleja con valores importantes tanto en DQO como en color, encontrando una buena parte de sus contaminantes en forma suspendida.
Comportamiento y remoción de la DQO
Para los resultados de remoción en DQO, en la Tabla 3 puede verse que las diferencias en los valores medios entre la mayoría de los grupos de tratamiento son mayores de lo que por casualidad cabría esperar; esto es, hay una diferencia estadísticamente significativa de acuerdo al análisis de varianza realizado (GL = 8, α = 0.009, F = 3.950).
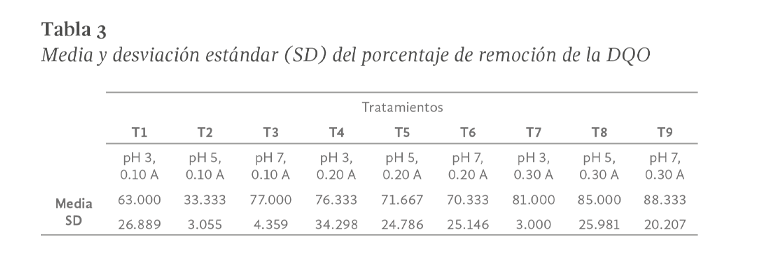
El procedimiento de la prueba mostrada en la Tabla 4, reveló que de 36 comparaciones realizadas, se obtuvieron diferencias significativas en 5 de ellas, donde los resultados obtenidos bajo esta prueba resultan estadísticamente significativos al presentar valores P≤0.05.
Respecto al comportamiento en la remoción del parámetro de DQO, en la Figura 2 se observa una tendencia a mejorar las remociones en este parámetro a medida que la intensidad de corriente fue incrementada, principalmente para el tiempo de reacción más favorable (90 min) donde se lograron las remociones máximas (100%), esto es, Figura 2c (pH 7 a 0.30 A). Esto muestra a la intensidad de corriente como uno de los parámetros operativos que mayor impacto llega a tener en la degradación de moléculas orgánicas complejas (González et al. 2011; Cruz 2013), pudiendo favorecer la interacción de las especies orgánicas y electrodos, a través de la transferencia de electrones. Mecanismos que, de acuerdo con Bermeo y Tinoco (2016), llegan a ocurrir en el ánodo, principalmente con los radicales hidroxilo fisisorbidos (•OH).
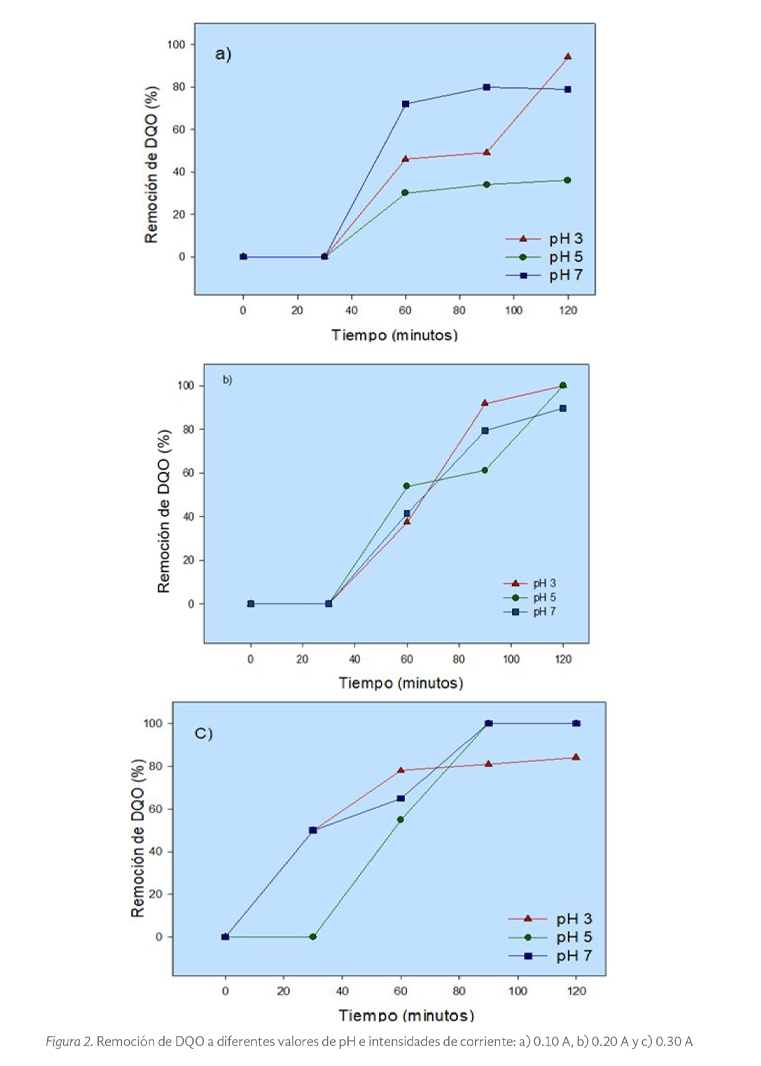
En la Figura 2a (0.10A) se observa que la mayor remoción en DQO (94%) se obtuvo a pH 3 hacia los 120 minutos de reacción. Los dos tratamientos restantes a pH 5 y 7 quedaron por debajo del 80%.
Para la condición 0.20A (Figura 2b), en los tratamientos a pH 3 y 5, se alcanzó una remoción del 100% en DQO, con un pH final de 4, y para el tratamiento a pH 7, aunque el valor de pH en el efluente final se mantuvo neutro, la remoción alcanzada fue inferior (89% en DQO).
Respecto a la Figura 2c, se tiene que la mayor remoción (100%) fue alcanzada a pH 5 y 7, y con solo 90 minutos de reacción. En general, los resultados obtenidos para los mejores tratamientos (100% de remoción en DQO), reflejan remociones superiores a las obtenidas en otros estudios, tal y como lo reportado por Bermeo y Tinoco (2016), quienes alcanzaron remociones ligeramente inferiores (96% en DQO), al trabajar con agua sintética de la industria textil, o al estudio reportado por Yingying et al. (2021) quienes reportan remociones del colorante azoico AV7 por debajo del 75% de remoción en DQO.
Comportamiento y remoción del color.
Para los resultados de remoción de color, también se aplicó un análisis de varianza tal y como se muestra en la Tabla 5. En este análisis se observó evidencia de diferencia significativa entre tratamientos (GL = 8, α = 0.013, F = 3.120).
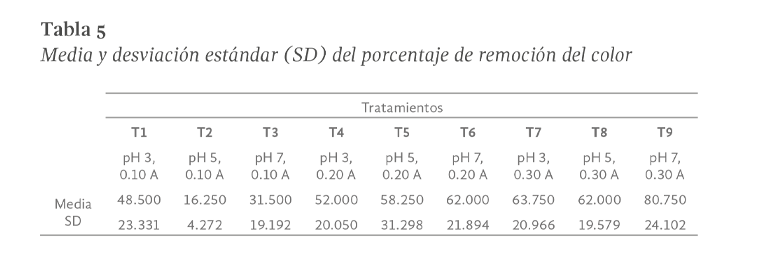
De este modo, la fuente de variación del nivel de significancia “P” indica que en alguna de las medias existe diferencia significativa puesto que P=0.013, en definitiva, el nivel de significancia resulta ser menor a 0.05. Para aislar el grupo o grupos que difieren de los demás, se utilizó la prueba de Tukey (Tabla 6).

En este sentido, el análisis de varianza realizado sobre las 36 comparaciones, nos permiten ver que la diferencia entre algunos de los porcentajes de remoción logrados por los tratamientos evaluados, es significativa en solo una comparación. De acuerdo al análisis mediante la prueba de Tukey, se observó que existe diferencia significativa entre las medias de las comparaciones en el tratamiento T9 vs T2; es decir pH 7, 0.30 A vs. pH 5, 0.10 A.
Para el caso de la remoción del parámetro de color, en la Figura 3 se observa que a una intesidad de corriente baja, los resultados se presentaron por debajo del 70%. Caso contrario con el resto de intensidades de corriente, donde los resultados se mostraron por encima del 80% de remoción.
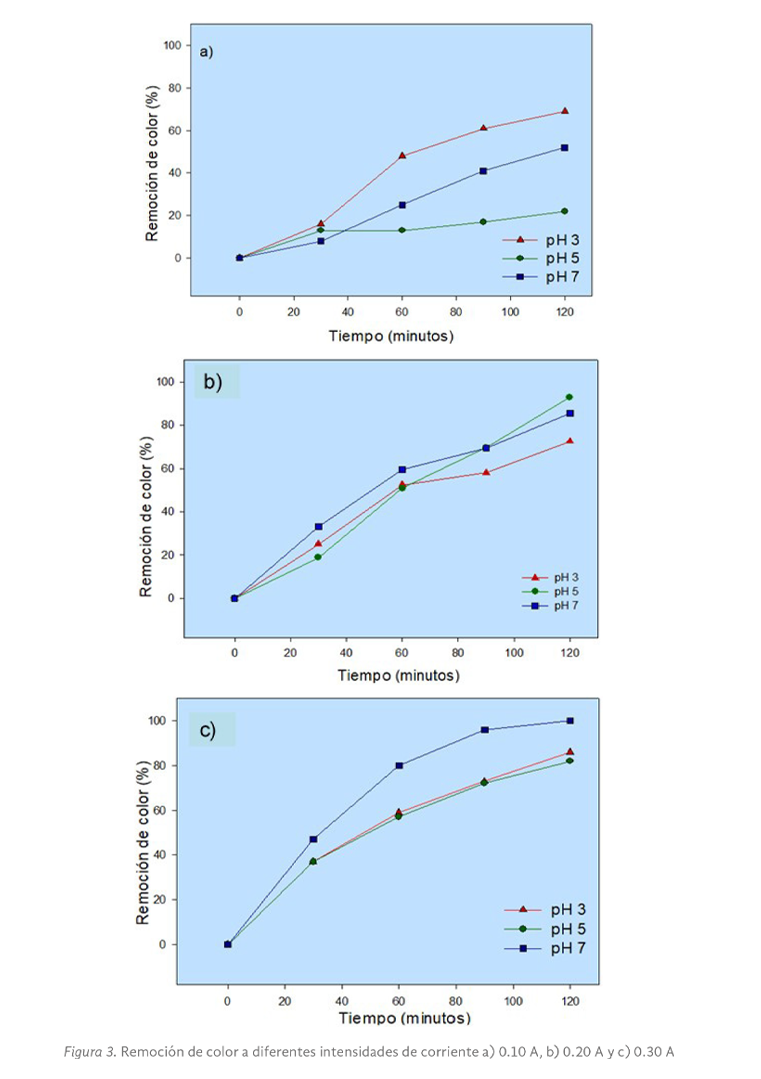
De la Figura 3 se observa que los 3 tratamientos ensayados a una intensidad de corriente de 0.10 A (Figura 3a), muestran las menores eficiencias de remoción de color, y en general en el rango del 22 al 69.26%.
Para la Figura 3b (intensidad de corriente de 0.20 A), se puede ver que para un tiempo de reacción de 120 minutos y con pH 5 y 7 se registraron las mayores remociones, esto es, 93 y 85%, respectivamente.
Finalmente, para la Figura 3c (intensidad de corriente de 0.30 A), las máximas remociones (100%) se tuvieron a pH 7 y para los tiempos de 90 y 120 minutos de reacción. Y al igual que sucedió con la DQO, también con este parámetro puede verse la influencia que la intensidad de corriente puede tener en la degradación de moléculas orgánicas complejas (González et al. 2011; Cruz 2013).
En general, en la descomposición de moléculas orgánicas complejas, los •OH producidos en el medio de reacción, de acuerdo con autores como Barrera-Andrade et al. (2023) y Milam y Planalp (2024), son eficaces en la descomposición de colorantes como el azul de metileno, presente en la mezcla de colorantes que caracteriza a los residuos de tinción de Gram. El proceso comienza mediante la adición de un radical hidroxilo al anillo o a la oxidación del átomo de azufre. Después de varias adiciones de radicales hidroxilo a los anillos de fenilo, la estructura del anillo puede romperse en fracciones fenólicas, dando paso a oxidaciones adicionales hasta la posible mineralización de la molécula (CO2 y H2O).
Por otro lado, se realizó el análisis de la caracterización final en el influente y efluente para las mejores combinaciones de pH y las diferentes intensidades de corriente. Los resultados son mostrados en la Tabla 7.
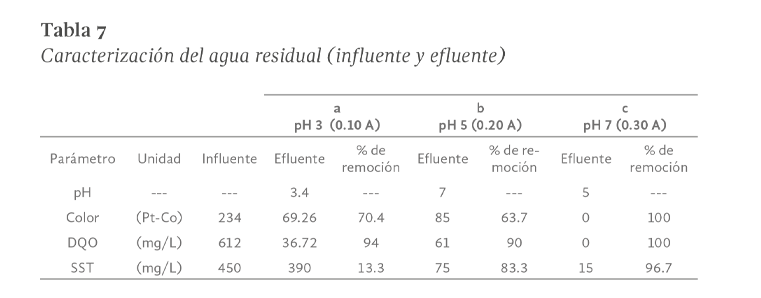
De la tabla se observa que tanto el color como la DQO registraron remociones del 100% bajo la combinación de pH 7 y 0.30 A, al registrar valores de 0 hacia el final del tratamiento. También resalta la baja presencia de SST en el efluente final (15 mg/L). Las remociones alcanzadas en el presente estudio, fueron mucho mayores a las reportadas en el único trabajo encontrado (Granda-Ramírez et al. 2018), donde un PAO como lo es la fotocatálisis heterogénea con TiO2 se ha aplicado a los residuos de la prueba de tinción de Gram, y solo un 40% de la DQO y un 75% de color fueron removidos.
Comportamiento de los parámetros evaluados y el error estadístico obtenido.
En las Figuras 4 y 5 se muestran los resultados de la remoción de color y DQO con respecto al error obtenido.
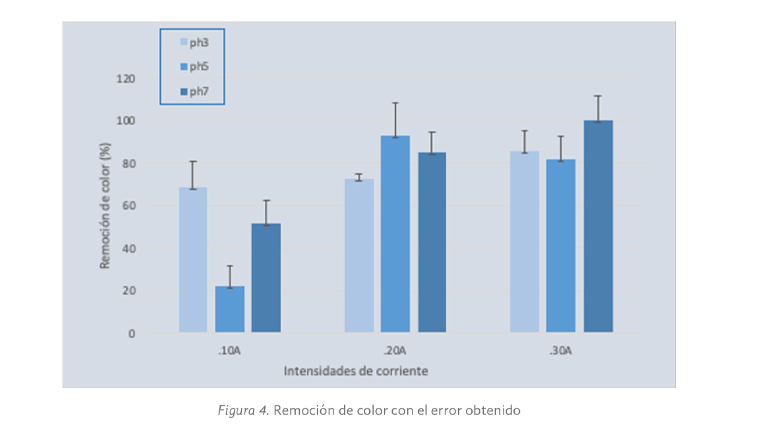
Como puede observarse y bajo las condiciones evaluadas, los valores de remoción en color no se encuentran dispersos, se observan aún más concentrados en el valor de pH 3 bajo 0.20 A. De cualquier forma es conveniente destacar la relación directa entre la remoción de color y la intensidad de corriente aplicada; en efecto, a mayor intensidad de corriente, el resultado de remoción en color resultó ser más significativo.
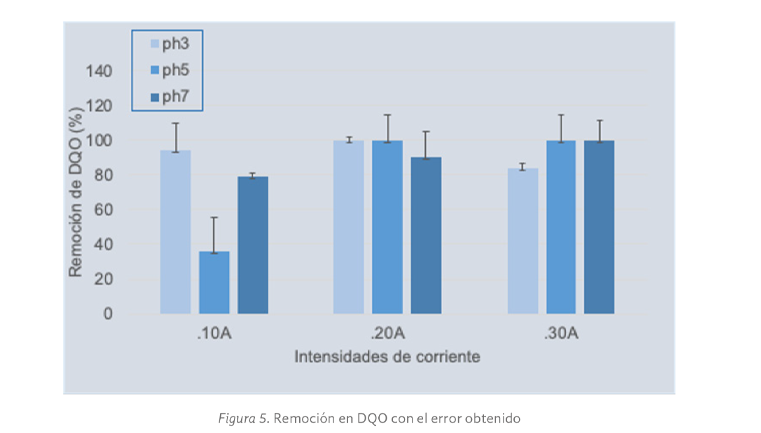
Para el caso de las pruebas de tratabilidad en remoción de DQO, se observó que para las condiciones evaluadas (0.10 A y pH 7, 0.20 A y pH 3, y 0.30 A y pH 3), los valores del error obtenido fueron concentrados y las remociones se encontraron por encima del 80%.
Conclusiones
La OA usando como ánodo el electrodo de DDB y como cátodo el electrodo de grafito, demostró ser eficiente para oxidar los contaminantes presentes en residuos líquidos provenientes de las pruebas de tinción de Gram, por lo que puede ser una opción real de tratamiento para esta mezcla compleja de colorantes generadas en ambientes escolares.
El ANOVA demostró la existencia de diferencias significativas entre los tratamientos. La prueba de Tukey permitió observar que las mejores condiciones de remoción 100% en DQO y Color, y del 96.7% en SST, se presentaron cuando el sistema fue operado con 300 mA y el pH neutro.
Finalmente, considerando que en el laboratorio de docencia de Ingeniería Ambiental de la UNICACH se generan en promedio 2 L de residuos líquidos de tinción de Gram de forma semestral, se requeriría tratar alrededor de 100 L del agua problema ya diluida, misma que podría ser descargada con valores de cero mg/L en DQO y cero unidades Pt-Co en color bajo las mejores condiciones encontradas en el presente estudio.
Referencias
APHA. (2012). Standard methods for the examination of water and wastewater (22nd ed.). Joint Editorial Board.
Barrera-Andrade, J. M., de la Fuente-Maldonado, N., López-Medina, R., Maubert-Franco, A. M., & Rojas-García, E. (2023). Revolutionizing wastewater treatment: Harnessing metal-organic frameworks for exceptional photocatalytic degradation of azo-type dyes. Colorants, 2, 674–704. https://doi.org/10.3390/colorants2040035
Barrera-Díaz, C., Canizares, P., Fernández, F. J., Natividad, R., & Rodrigo, M. A. (2014). Electrochemical advanced oxidation processes: An overview of the current applications to actual industrial effluents. Journal of the Mexican Chemical Society, 58(3), 256-275. http://www.redalyc.org/articulo.oa?id=47532759003
Bermeo-Garay, M., & Tinoco-Gómez, O. (2016). Remoción de colorantes de efluente sintético de industria textil aplicando tecnología avanzada. Industrial Data, 19(2), 91-95. http://dx.doi.org/10.15381/idata.v19i2.12844
Brdarić, T. P., Aćimović, D. D., Švorc, L., & Vasić Anićijević, D. D. (2024). Bibliometric study of electrochemical advanced oxidation processes (EAOPs) for wastewater treatment. Coatings, 14, 1060. https://doi.org/10.3390/coatings14081060
Chiliquinga, M., Espinoza-Montero, P. J., Rodríguez, O., Picos, A., Bandala, E. R., Gutiérrez-Granados, S., & Peralta-Hernández, J. M. (2020). Simultaneous electrochemical generation of ferrate and oxygen radicals to blue BR dye degradation. Processes, 8(7), 753. https://doi.org/10.3390/pr8070753
Granda-Ramírez, C. F., Hincapié-Mejía, G. M., & Lopera-Uribe, S. (2018). Tratamiento de residuos de laboratorio vía fotocatálisis heterogénea con TiO2. TecnoLógicas, 21(42), 1-12. https://doi.org/10.22430/22565337.787
Cruz Ornelas, R. (2013). Oxidación electroquímica de residuos farmacéuticos (diclofenaco, ketorolaco y naproxeno) en diferentes matrices acuosas [Tesis de posgrado, El Colegio de la Frontera Sur (ECOSUR)].
González, T., Domínguez, J. R., Palo, P., & Sánchez‐Martín, J. (2011). Conductive-diamond electrochemical advanced oxidation of naproxen in aqueous solution: Optimizing the process. Journal of Chemical Technology & Biotechnology, 86(1), 121-127. https://doi.org/10.1002/jctb.2494
Hanane-Afanga, H., Zazou, E., Titchou, F., Youness-Rakhila, R., Ait Akbour, R., Elmchaouri, A., & Ghanbaja, J. (2020). Integrated electrochemical processes for textile industry wastewater treatment: System performances and sludge settling characteristics. Sustainable Environment Research, 30, 1-11. https://doi.org/10.1186/s42834-019-0043-2
Xie, J., Zhang, C., & Waite, T. D. (2022). Hydroxyl radicals in anodic oxidation systems: Generation, identification, and quantification. Water Research, 217, 118425. https://doi.org/10.1016/j.watres.2022.118425
Klidi, N., Clematis, D., Delucchi, M., Gadri, A., Ammar, S., & Panizza, M. (2018). Applicability of electrochemical methods to paper mill wastewater for reuse: Anodic oxidation with BDD and TiRuSnO2 anodes. Journal of Electroanalytical Chemistry, 815, 16-23. https://doi.org/10.1016/j.jelechem.2018.02.063
La Rosa-Toro, A., & Ponce-Vargas, M. (2007). Evaluación de electrodos de espinela de cobalto y de dióxido de plomo en la oxidación electroquímica de colorantes azo. Revista de la Sociedad Química del Perú, 73(4), 183-196. http://www.redalyc.org/articulo.oa?id=371937607002
Milam, L. R., & Planalp, R. P. (2024). Bimetallic Fenton-like catalysts in the remediation of dyes. Colorants, 3, 1–16. https://doi.org/10.3390/colorants3010001
Moreira, F. C., Boaventura, R. A., Brillas, E., & Vilar, V. J. (2017). Electrochemical advanced oxidation processes: A review on their application to synthetic and real wastewaters. Applied Catalysis B: Environmental, 202, 217-261. https://doi.org/10.1016/j.apcatb.2016.08.037
Nidheesh, P. V., Zhou, M., & Oturan, M. A. (2018). An overview on the removal of synthetic dyes from water by electrochemical advanced oxidation processes. Chemosphere, 197, 210-227. https://doi.org/10.1016/j.chemosphere.2017.12.195
Petrucci, E., Di Palma, L., Lavecchia, R., & Zuorro, A. (2015). Treatment of diazo dye Reactive Green 19 by anodic oxidation on a boron-doped diamond electrode. Journal of Industrial and Engineering Chemistry, 26, 116-121. https://doi.org/10.1016/j.jiec.2014.06.014
Rubí, H., Galicia, L. E. M., Soto, M., & Gálvez, F. A. V. (2023). Perspectiva de la oxidación electroquímica de colorantes sintéticos en aguas residuales artificiales: Rol del material anódico. CULCyT: Cultura Científica y Tecnológica, 20(3), 1. https://doi.org/10.20983/culcyt.2023.3.3.1
Sánchez-Sánchez, T. J., Nájera-Aguilar, H. A., Gutiérrez-Hernández, R. F., García-Lara, C. M., Araiza-Aguilar, J. A., Bautista-Ramírez, J. A., & Castañón-González, J. H. (2020). Application of anodic oxidation with graphite electrodes in pretreated leachates. Open Journal of Applied Sciences, 10(3), 69-77. https://doi.org/10.4236/ojapps.2020.103006
Velázquez, J. M. (2015). Influencia de la concentración de cloruros en la remoción de color y materia orgánica (DQO y COT) en lixiviados tipo III empleando el proceso de oxidación anódica [Tesis, Universidad de Ciencias y Artes de Chiapas].
Xie J, et al. (2022) An integrated model for termination of RNA polymerase III transcription. Sci Adv 8(28):eabm9875
Yingying, J., Zhao, H., Liang, J., Yue, L., Li, T., Luo, Y., Liu, Q., Lu, S., Asiri, A. M., Gong, Z., & Sun, X. (2021). Anodic oxidation for the degradation of organic pollutants: Anode materials, operating conditions, and mechanisms. A mini review. Electrochemistry Communications, 123, 106912. https://doi.org/10.1016/j.elecom.2020.106912
Yavuz, Y., & Shahbazi, R. (2012). Anodic oxidation of Reactive Black 5 dye using boron doped diamond anodes in a bipolar trickle tower reactor. Separation and Purification Technology, 85, 130-136. https://doi.org/10.1016/j.seppur.2011.10
 https://orcid.org/0009-0009-4965-6928
https://orcid.org/0009-0009-4965-6928
 https://orcid.org/0009-0009-4333-1946
https://orcid.org/0009-0009-4333-1946
 https://orcid.org/0000-0002-9337-8242
https://orcid.org/0000-0002-9337-8242
 https://orcid.org/0000-0001-8642-9075
https://orcid.org/0000-0001-8642-9075
 https://orcid.org/0000-0002-3530-0674
https://orcid.org/0000-0002-3530-0674












