Introducción
La baja disposición de agua para consumo humano es uno de los temas de salud más significativos en la actualidad, ya que es un recurso utilizado para abastecimiento, alimentación, recreación, economía, entre otros. En México, alrededor de 80% de los ecosistemas acuáticos tienen algún grado de contaminación. Los principales contaminantes observados son materia orgánica, nutrientes como nitrógeno y fósforo y microorganismos (coliformes fecales) (Hernández, et al. 2020). Existen diferentes técnicas convencionales y no convencionales para la eliminación de microorganismos en el agua como son la aplicación de productos químicos, esterilización UV y ósmosis inversa (Faroon, et al. 2023), para el primer caso y nanofiltración (Nasir, et al. 2022), electrocoagulación (Gamero, et al. 2020), fotosensibilización (Santos, et al. 2023), entre otros, como segundo caso. Este último representa una alternativa de bajo costo para la desinfección del agua utilizando la radiación solar y colorantes, los cuales son estructuras químicas utilizadas por sus propiedades de coloración, se les clasifica en naturales por su origen vegetal, animal o mineral (colorantes) y artificiales debido a modificaciones físicas o químicas, absorben luz y dan color en la región visible del espectro (400-800 nm). Por sus características son empleados además en sustratos para darles color y puedan resistir la decoloración al ser expuestos en agua, agentes oxidantes, sudor y ataque microbiano, por lo que también son utilizados en industrias como la textil, alimentos, impresión, cosméticos, medicina, plásticos, concreto y papel. Uno de los colorantes más utilizados en la industria es el azul de metileno, el cual es comúnmente aplicado para colorear seda, lana, algodón y papel (Rodríguez-Basantes, et al. 2019).
En este trabajo se presenta el proceso de extracción de dos diferentes colorantes orgánicos, así como la determinación del color verdadero, comparándolos con la Indigofera suffruticosa y azul de metileno.
Materiales y Método
El procedimiento a seguir para la extracción del colorante es la selección de una masa determinada de la especie vegetal elegida (semillas u hojas), si esta se compone de hojas se procede a trocearla para disminuir el tiempo de obtención de colorante. A continuación, se presentan dos técnicas de extracción, la primera utiliza agua a temperatura de ebullición con la especie vegetal elegida y con agitación constante a 200 RPM durante 10 minutos, se deja enfriar y se filtra el líquido utilizando papel filtro, se procede a concentrar el extracto hirviendo la disolución o poniéndola a baño María, este proceso se repite en algunos casos hasta en 4 ocasiones para obtener la mayor cantidad de colorante posible. La segunda es utilizando una solución de hidróxido de sodio o hidróxido de potasio (medio alcalino) a una concentración de 1.5% o también utilizando alcohol etílico concentrado para extraer el colorante bajo agitación constante a 150 RPM en tiempos que van desde 10 minutos hasta 1 hora, dependiendo de la especie vegetal, para el caso de utilizar medio alcalino, se procede a acidificar la solución utilizando ácido fosfórico al 10% (H3PO4) con agitación constante hasta alcanzar un pH entre 2 y 2.5, finalmente se concentra el extracto mediante decantación del material y secado en horno a una temperatura óptima de manera que no se modifique las propiedades del colorante. Para su conservación se puede congelar el material concentrado o agregarle alcohol etílico en proporción 1:8 (Rodríguez-Basantes, et al. 2019). La masa final de colorante obtenida se mide utilizando una balanza analítica de la marca OHAUS modelo PIONEER TJ2611 con precisión de 0.1mg para conocer la eficiencia en su extracción.
Para el análisis espectral se sigue el procedimiento descrito en la NMX-AA-017-SCFI-2021, para la medición de color verdadero en aguas naturales, residuales, residuales tratadas y marinas, mediante coeficientes de absorción espectral a tres longitudes de onda diferentes en el intervalo visible del espectro (436, 525 y 620 nm) utilizando
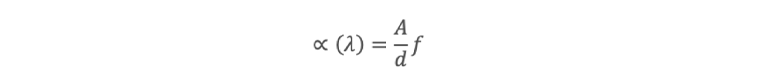
Donde A es la absorbancia de la muestra de agua a la longitud de onda λ, d es la distancia en mm de camino óptico a través de la celda contenedora de la muestra de agua y f es un factor para obtener el coeficiente espectral en m-1 (f=1000). El estudio se realizó con un espectrofotómetro UV/VIS marca HACH modelo DR6000. El color verdadero se expresa en función del coeficiente de absorción espectral a la longitud de onda analizada, así como el valor de pH de la muestra, si la muestra es diluida se evalúa el volumen de agua utilizado en el cálculo final del color verdadero.
Resultados
Se utilizaron tres diferentes materias primas como son el añil, achiote y col morada para la obtención de colorantes orgánicos, los cuales fueron contrastados con azul de metileno. A continuación, se describe el proceso de obtención de cada uno.
Para el Añil, proveniente de la Indigofera suffructicosa, se tuvo un colorante con una presentación sólida, por lo que para su preparación se molió hasta obtener gránulos inferiores a un diámetro de 0.5 mm. A continuación, se colocó una masa de 800 mg de añil en 400 mL de agua destilada, se mantuvo en agitación durante 10 minutos a 200 RPM para homogenizar la mezcla hasta obtener una concentración de 2 g/L, con un pH promedio de 7.0.
A partir de esta concentración, se prepararon 9 diluciones disminuyendo la concentración en valores periódicos, hasta alcanzar una concentración mínima de 200mg/L.
En el caso de la Bixa Orellana (Achiote), se realizaron dos procedimientos para la obtención del colorante, en el primero se colocó una masa de 100 g de semillas de achiote con 150 mL de agua destilada en un matraz erlenmeyer, se hirvió a una temperatura de 150°C con una agitación constante a 200 RPM en una parrilla de calentamiento y agitación marca Thermo Scientific modelo Cimarec durante 15 minutos, cuidando que las semillas no se adhirieran a las paredes del matraz. Una vez transcurrido el tiempo se procedió a filtrar la mezcla para eliminar las semillas lavadas de achiote utilizando un colador de malla regular de nylon, el líquido obtenido se depositó en tres capsulas de porcelana distribuido en volúmenes iguales, para su posterior secado. Debido a que el primer proceso no removió completamente el colorante de las semillas de achiote, se procedió a una segunda lavada con las mismas condiciones de la primera. Las capsulas de porcelana con el líquido obtenido se depositaron en un horno de secado marca Biobase, modelo FCD-3000 Serials, previamente acondicionado a una temperatura de 60°C durante 8 horas aproximadamente.

Debido a que el extracto obtenido, a pesar de las lavadas realizadas, presentó una consistencia espesa que inhibe el proceso de extracción se debió utilizar un volumen mayor de agua, una masa menor de semillas de achiote o número mayor de lavadas. Una vez concluido el proceso de extracción del colorante, se procedió a evaluar la masa y su eficiencia de remoción, obteniéndose 0.9397g de colorante, lo que representa una eficiencia de remoción del 93.32%.
Para el segundo procedimiento, se utilizaron 10 g de semilla de achiote y 30 mL de un medio alcalino (NaOH o KOH), ambas soluciones a una concentración de 1.5%, la mezcla se mantuvo en agitación constante a 140 RPM durante 1 hora, posteriormente se dejó en digestión durante 24 horas, transcurrido el tiempo se separaron las semillas y se realizó un segundo lavado repitiendo el proceso antes descrito, los extractos obtenidos por cada lavada se unieron y se procedió a su acidificación agregando gotas de ácido fosfórico al 10% (H3PO4) con agitación constante a 150 RPM hasta alcanzar un pH de 2 a 2.5, por último se decantó el material para la separación de las semillas, dejando secar el líquido durante tres días a temperatura ambiente en un espacio controlado. La masa obtenida utilizando hidróxido de sodio fue en promedio de 1.2 g, mientras que utilizando hidróxido de potasio fue de 1.8 g.
Para la Brassica oleracea, var. capitata (col morada), se troceó finamente 463.85g de col morada (6 hojas) y se dividió en cuatro bloques de 115g, aproximadamente. A cada bloque contenido en vasos de precipitado se le agregó 460 mL de agua destilada previamente hervida durante 30 minutos con agitación magnética. Dos lotes se dejaron enfriar a temperatura ambiente y a continuación, se les agregó 1/8 de su volumen de alcohol etílico concentrado para su conservación, evaluación y para evitar la proliferación de microorganismos. Los otros dos lotes, se redujeron mediante evaporación a una temperatura promedio 250°C durante una hora, por lo que se obtuvo una disminución de 100 y 55 mL, respectivamente.
Absorbancia
Con los colorantes obtenidos de cada especie vegetal se procedió a determinar una concentración de estos y de una solución de azul de metileno de tal forma que al medir la absorbancia se tuvieran valores cercanos entre sí, obteniendo las curvas que se presentan en la figura 2.
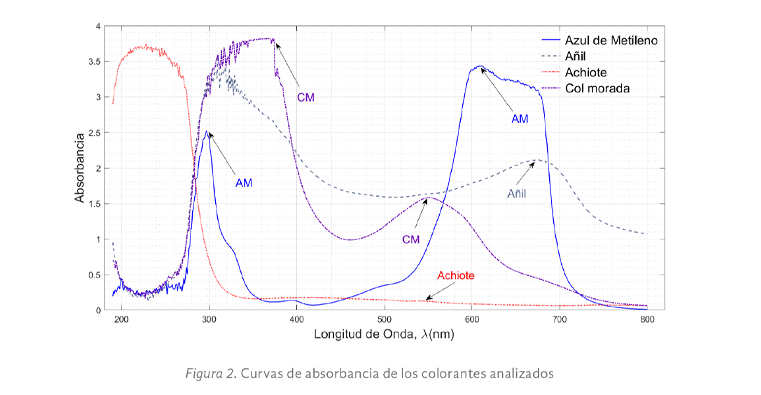
De la figura 2, se observó la mayor absorbancia para el azul de metileno a una concentración de 10 mg/L fue a 610 nm lo cual indica mayor temperatura pero menor energía, similar al observado en otros trabajos como Amaya, 2023, que presentó un análisis desde 390 a 800 nm, sin embargo, en este caso se realizó un barrido desde 190 nm presentando un segundo pico de absorbancia a los 297 nm, que corresponde a una frecuencia alta de luz, este rango de longitud de onda con mayor energía permite su uso en medicina para eliminar población microbiana y en tratamiento de agua (Santos, et al. 2023). Para el Añil a una concentración de 2 g/L, se tuvo mayor absorbancia alrededor de 310 nm y 675 nm acorde a lo observado por Basuki, 2018. En el caso del achiote con una concentración de 22.5 mg/L, se determinó un pico de absorbancia a una longitud de onda inferior a los 300 nm lo que corresponde a rangos de mayor energía útil en medicina, las bandas de absorbancia características entre 250, 370 y 500-545 nm están indicadas para antocianinas. La absorción de esta última banda varía con el pH del medio y lo que permite detectar el tipo de antocianina. La col morada presentó dos picos de absorbancia a 370 nm y 550 nm, valores cercanos a los observados por Paez-Cartaya, 2018.
Color Verdadero
Para determinar el color verdadero de las sustancias disueltas en agua, se procedió al cálculo del coeficiente de absorción espectral a 436, 525 y 620 nm, todas las muestras al ser diluidas en agua destilada elevaron su pH a valores cercanos a 7.0. A continuación, se determinó la curva de calibración empleando el azul de metileno a diferentes concentraciones que van desde 0.1 hasta 10 mg/L.
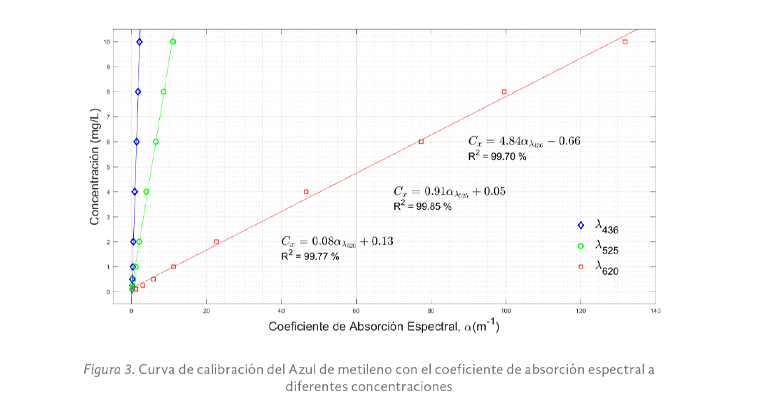
La figura 3, presentó la relación lineal entre el coeficiente de absorción espectral y la concentración del colorante a diferentes diluciones. El valor del coeficiente de absorción espectral para cada longitud de onda representó el color verdadero tomando en consideración las diluciones realizadas para cada concentración. En la gráfica, se observó diferentes pendientes para cada longitud de onda analizada, la correspondiente a 620 nm que es a la que se obtuvo la máxima absorbancia del colorante, implica mayor sensibilidad del método analítico debido a la pendiente prolongada encontrada y mayor control de gradientes de color, se determinó un coeficiente de determinación R2 superior al 99% en todas las longitudes de onda analizadas lo que indicó una fuerte relación lineal entre las variables. Las expresiones encontradas permitirán asegurar que la aplicación final que se le de al colorante sea la deseada debido a que el tono o color requerido será exacto controlando la concentración del mismo.
La figura 4, presentó la curva de calibración del añil, en donde no se observó una diferencia significativa entre las longitudes de onda analizadas los que infiere no estar dentro de algún pico máximo de absorbancia, por lo que el color verdadero variará únicamente en brillo.
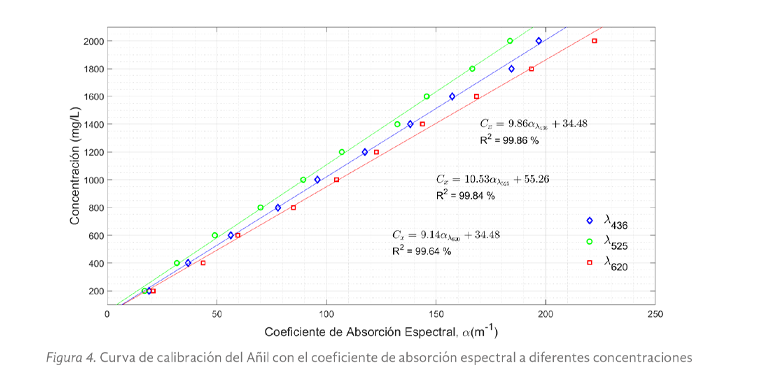
Cabe señalar que el añil al ser diluido en agua destilada no presentó una solución homogénea, es decir, se observó sedimentación o residuos de éste esparcidos en el recipiente, lo cual implicó variaciones en la concentración que dependen de las condiciones iniciales del colorante.
Para la curva de la figura 5, se prepararon 4 diluciones del colorante obtenido del achiote disminuyendo la concentración de 22.5 a 12.5 mg/L, se observó mayor sensibilidad a 436 nm, además de la mejor aproximación con una R2 arriba del 98%. Se presentaron además valores bajos en el coeficiente de absorción espectral lo que indica que ha bajas concentraciones de achiote se obtuvo un color intenso en la solución.
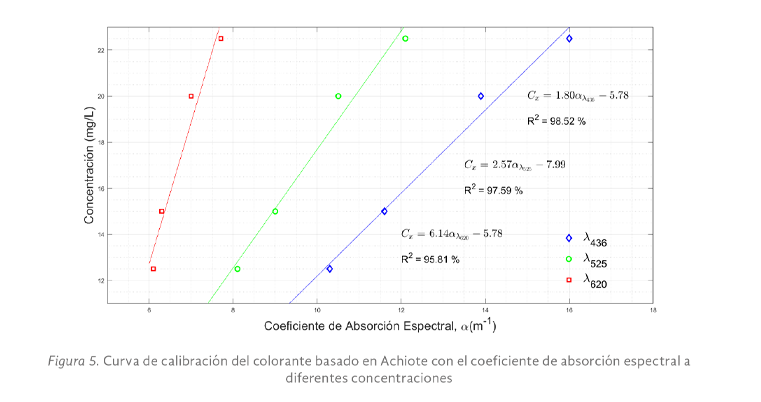
Para este colorante, el método de obtención elegido fue el segundo basado en hidróxido de sodio a una concentración de 1.5% y ácido fosfórico al 10%, lo anterior debido a que el primer método presentó sedimentación al diluirlo en agua, mientras que para el segundo se obtuvo una mezcla homogénea.
Para el colorante obtenido de la col morada se prepararon 10 diluciones, disminuyendo la concentración inicial en valores periódicos hasta que se obtuvo un mínimo del 5%, como se presenta en la figura 6. Se observó mayor sensibilidad a 525 nm. Es importante señalar que este colorante ha sido propuesto como indicador de pH debido a la sensibilidad que presentó mediante cambios visibles en color, lo que resulta eficaz en el desarrollo de biosensores para la conservación de alimentos (Molina-Arteaga, et al. 2022).
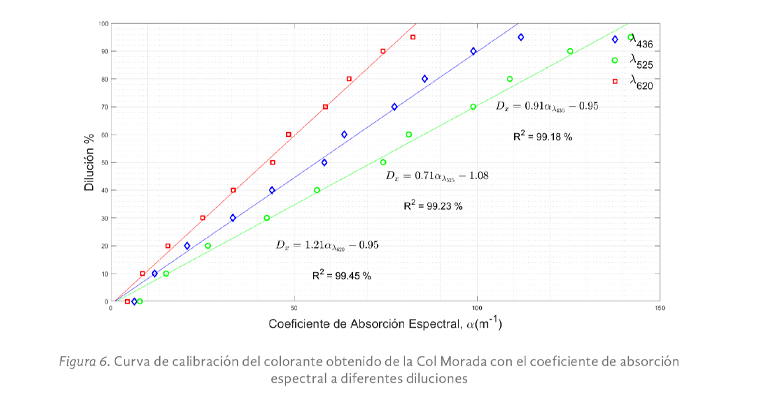
Con las ecuaciones obtenidas para cada uno de los colorantes, fue posible determinar el coeficiente absorción espectral a una concentración desconocida de estos con una R2 superior al 99% en las tres longitudes de onda, solo en el caso del achiote se tuvo un coeficiente de determinación inferior al 96% a 620 nm, estas ecuaciones ayudarán a simplificar el sistema de monitoreo en caso de no contar con un espectrómetro que realice el barrido en el espectro visible, lo anterior mediante el empleo de un sensor de color que evalúe las absorbancias a longitudes de onda de 436, 525 y 620 nm, respectivamente.
Conclusiones
Se presentaron procesos de obtención de colorantes solubles en agua. Utilizando como solvente hidróxido de potasio e hidróxido de sodio para la extracción del colorante del achiote por sus ventajas económicas y agua para la col morada.
Se determinaron las absorbancias de diferentes colorantes orgánicos a concentraciones de 2g/L y 12 mg/L, correspondientes al añil y achiote, respectivamente, los colorantes analizados presentaron absorbancias altas en longitudes de onda menores a los 400 nm lo que corresponde a alta energía, lo que los hace viables en áreas como la medicina y tratamiento terciario de agua.
Se obtuvieron relaciones lineales entre el coeficiente de absorción espectral y las concentraciones de los colorantes utilizados observando variaciones en el gradiente de color para el caso del azul de metileno y variaciones en el brillo para el caso de los colorantes orgánicos.
Se observaron coeficientes de determinación R2 superiores al 99% en la mayoría de los casos, lo que indica una elevada relación del modelo de regresión lineal a los datos reales y permite simplificar el procedimiento de color verdadero con un detector de color que abarque las longitudes de onda propuestas en la NMX-AA-017-SCFI-2021.
Referencias
Amaya Vesga, Á. A., Carvajal Grimaldos, A. C., Gómez Tarazona, R. A. y Mendoza Castellanos, Y. R. (2023). Demostración práctica de la importancia de la longitud de onda en la espectroscopía Ultravioleta Visible. Educación Química, 34(2), 40-49. http://dx.doi.org/10.22201/fq.18708404e.2023.2.83275
Basuki, Suyitno and Kristiawan, B. Absorbance and electrochemical properties of natural indigo dye. 2018. AIP Conf. Proc. 1931, 030067. https://doi.org/10.1063/1.5024126.
Faroon, M., ALSaad, Z., Albadran, F., & Ahmed, L. (2023). Review on Technology-Based on Reverse Osmosis. Anbar Journal of Engineering Sciences, 14(1), 89-97. DOI: 10.37649/aengs.2023.139414.1047
Gamero-Quijano, A., García, P., & La Rosa-Toro-Gómez, A. (2020). Remoción de bacterias patógenas del agua mediante electrocoagulación con ánodos de aluminio / Removal of pathogenic microorganisms from water by electrocoagulation with aluminum electrodes. Tecnología Y Ciencias Del Agua, 11(4), 136-178. https://doi.org/10.24850/j-tyca-2020-04-05
Hernández Vargas, O., Mancilla Villa, O. R., Palomera García, C., Olguín López, J. L., Flores Magdaleno, H., Can Chulim, Álvaro, Ortega Escobar, H. M., & Sánchez Bernal, E. I. (2020). Evaluación de la calidad del agua y de la ribera en dos cuencas tributarias del río Tuxcacuesco, Jalisco, México. Revista Internacional De Contaminación Ambiental, 36(3), 689–701. https://doi.org/10.20937/RICA.53595
Molina-Arteaga, N.I., Toala-Zambrano, A.N., Sanchéz, F., Macías-Pro, M.A., Rosero-Delgado, E.A. (2022). Antocianinas como biosensores en la conservación de alimentos. Revista Bases de la Ciencia, 7(2), 15-32. https://doi.org/10.33936/revbasdelaciencia.v7i2.4449
Nasir, A. M., Adam, M. R., Mohamad Kamal, S. N. E. A., Jaafar, J., Othman, M. H. D., Ismail, A. F., Aziz, F., Yusof, N., Bilad, M. R., Mohamud, R., A Rahman, M., & Wan Salleh, W. N. (2022). A review of the potential of conventional and advanced membrane technology in the removal of pathogens from wastewater. Separation and purification technology, 286, 120454. https://doi.org/10.1016/j.seppur.2022.120454
Paez-Cartaya, I., Rodríguez-Sánchez, J. L., Cruz-Viera, L. (2018). Optimización de la extracción de antocianinas de Hibiscus sabdariffa L. y su caracterización cromática. Ciencia y Tecnología De Alimentos, 28(2), 17-21. https://revcitecal.iiia.edu.cu/revista/index.php/RCTA/article/view/56
Rodríguez-Basantes, A. I., Esparza-Bonilla, C. J., & Huacho-Chávez, I. F. (2019). Obtención de antocianinas de la Brassica oleracea var.Capitata para el uso en alimentos. Dominio De Las Ciencias, 5(1), 652–666. https://doi.org/10.23857/dc.v5i1.1067
Santos, A. D., Gonçalves, D., Martins, R. C., Gmurek, M., Nogueira, A., Castro-Silva, S., Castro, L. M., & Quinta-Ferreira, R. (2023). Homogeneous Photosensitized Oxidation for Water Reuse in Cellars: A Study of Different Photosensitizers. Sustainability, 15(8), 6861. https://doi.org/10.3390/su15086861
 https://orcid.org/0000-0001-5860-266X
https://orcid.org/0000-0001-5860-266X
 https://orcid.org/0000-0002-9337-8242
https://orcid.org/0000-0002-9337-8242
 https://orcid.org/0000-0002-3530-0674
https://orcid.org/0000-0002-3530-0674